Paul M. O’Byrne
New treatment approaches for asthma. Polskie Archiwum Medycyny Wewnętrznej, 2013; 123 (1–2): 11–13
Tłumaczył dr n. med. Piotr Gajewski
Skróty: FEV1 – natężona objętość wydechowa pierwszosekundowa, GKSw – glikokortykosteroidy wziewne, LABA – długo działające β2‑mimetyki wziewne, LAMA – długo działające antagonisty muskarynowe
Wprowadzenie
Według wytycznych postępowania w astmie głównym celem leczenia jest osiągnięcie kontroli choroby. Kontrola astmy obejmuje dwa aspekty. Pierwszy to optymalna kontrola bieżąca (z dnia na dzień), definiowana jako maksymalne ograniczenie objawów występujących w ciągu dnia i w nocy, bez ograniczenia aktywności fizycznej, minimalne użycie leków rozszerzających oskrzela przyjmowanych doraźne i bez zwężenia dróg oddechowych. Drugi aspekt to zminimalizowanie przyszłego ryzyka, definiowanego jako długoterminowa utrata czynności płuc, ciężkie zaostrzenia astmy i niepożądane skutki działania stosowanych leków (ryc. 1).
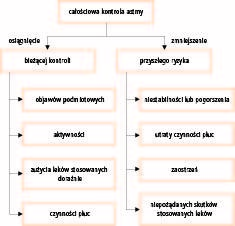
Ryc. 1. Definicja całościowej kontroli astmy
Te dwa aspekty kontroli astmy nie są niezależne. Im gorsza jest kontrola astmy z dnia na dzień, tym większe ryzyko wystąpienia ciężkiego zaostrzenia astmy.
W przeszłości lekarze często mieli wątpliwości co do znaczenia określeń „kontrola astmy” i „ciężkość astmy”. Sądzono, że astma dobrze kontrolowana jest synonimem astmy lekkiej, a astma słabo kontrolowana synonimem astmy ciężkiej. Takie rozumowanie nie jest prawidłowe.
Ciężkość to nasilenie procesu chorobowego przed leczeniem, a kontrola to odpowiedź na leczenie. U chorych na ciężką astmę, jeśli się stosuje właściwe leczenie, można uzyskać dobrą kontrolę choroby, natomiast chorzy na astmę lekką, jeśli nie przestrzegają leczenia zgodnego z wytycznymi, będą mieli astmę niekontrolowaną, którą można postrzegać jako ciężką. Cele leczenia astmy są takie same niezależnie od stopnia ciężkości choroby. Uzyskanie kontroli choroby u pacjentów z ciężką astmą często będzie trudniejsze, ale skuteczne leczenie może taką pełną kontrolę zapewnić. Pomimo dostępności skutecznych i bezpiecznych leków do leczenia astmy, z których najważniejsze to glikokortykosteroidy wziewne (GKSw), stosowane w monoterapii lub w połączeniu z długo działającymi β2-mimetykami wziewnymi (LABA), u niektórych pacjentów nie udaje się uzyskać dobrej kontroli choroby.
Najważniejszą przyczyną takiej sytuacji jest nieprzestrzeganie zaleceń dotyczących leczenia. Gdy chorzy przyjmują przepisane leki przeciwastmatyczne, wielu z nich może osiągnąć dobrą kontrolę astmy. W niektórych przypadkach jednak astma jest tylko częściowo kontrolowana, i wówczas chory razem z lekarzem muszą podjąć decyzję, czy zwiększyć intensywność leczenia, czy zaakceptować niepełną kontrolę choroby. Jednakże we wszystkich wytycznych się wskazuje, że jeśli astma nie jest kontrolowana, należy starannie rozważyć możliwości leczenia i je zintensyfikować.
Nowe kierunki leczenia
Istnieje grupa chorych na astmę, u których pomimo leczenia optymalnymi dawkami leków przeciwastmatycznych choroba nie jest kontrolowana i którzy są obciążeni ryzykiem wystąpienia ciężkich zaostrzeń astmy. Tacy chorzy z ciężką astmą oporną na leczenie stanowią 5–10% całej populacji astmatyków. W grupie pacjentów określenie fenotypu (szczegółowej charakterystyki) choroby w odniesieniu do stanu atopii i rodzaju zapalenia dróg oddechowych może dostarczyć dodatkowych informacji przydatnych przy wyborze sposobu leczenia. Dla chorych z oporną ciężką astmą opracowano szereg nowych terapii skierowanych na określone komórki zapalne, uważane za ważne w podtrzymywaniu astmy lub w ciężkich zaostrzeniach astmy.
Leczenie skierowane na eozynofilię dróg oddechowych
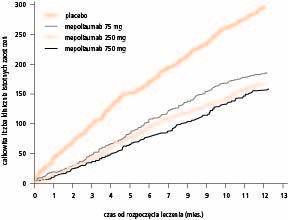
Przesłanką do opracowania jednej z nowych metod leczenia było zidentyfikowanie grupy chorych na oporną ciężką astmę z utrzymującą się eozynofilią dróg oddechowych.Badania wykazały, że zahamowanie eozynofilii dróg oddechowych za pomocą humanizowanego przeciwciała monoklonalnego przeciwko interleukinie 5 (IL‑5) – mepolizumabu zmniejsza ryzyko ciężkich zaostrzeń astmy i może poprawić czynność płuc oraz kontrolę choroby. W następnym, większym badaniu z randomizacją, z podwójnie ślepą próbą i z użyciem placebo w grupie kontrolnej oceniano efekty leczenia mepolizumabem stosowanym przez rok w 3 różnych dawkach u chorych z nawracającymi ciężkim zaostrzeniami astmy w wywiadach i cechami zapalenia eozynofilowego. U chorych leczonych mepolizumabem częstość ciężkich zaostrzeń astmy zmniejszyła się istotnie o 50%, przy czym nie stwierdzono większych korzyści ze stosowania leku w większych dawkach (ryc. 2).
Ryc. 2. Wpływ leczenia 3 różnymi dawkami mepolizumabu (monoklonalnego przeciwciała przeciwko interleukinie 5) w porównaniu z placebo na występowanie klinicznie istotnych zaostrzeń astmy w ciągu roku. Wszystkie 3 dawki istotnie zmniejszyły częstość zaostrzeń astmy i nie było istotnej zależności od dawki (przedruk za zgodą z 12. poz. piśmiennictwa).
Opublikowano w miesięczniku Medycyna Praktyczna 4/2013
Wyniki tych badań wskazują, że leczenie skierowane na IL‑5 może przynieść istotne korzyści kliniczne u chorych z oporną ciężką astmą i utrzymującą się eozynofilią dróg oddechowych.
Leczenie skierowane na neutrofilię dróg oddechowych
U około połowy chorych na astmę występuje nieeozynofilowe zapalenie dróg oddechowych, często neutrofilowe.13 Nie jest jednak jasne, czy neutrofile przyczyniają się do braku kontroli astmy lub do występowania zaostrzeń. Migracja neutrofilów jest częściowo wynikiem aktywacji receptora chemokin CXCR2. Jest to receptor sprzężony z białkami G, blokowany przez antagonistów drobnocząsteczkowych, a pobudzany przez szereg agonistów, w tym interleukinę 8 oraz onkogen związany ze wzrostem (growth‑regulated oncogene – GRO) typu α i β. Jednego z takich antagonistów (SCH527 123) użyto w małym badaniu z randomizacją i z podwójnie ślepą próbą, trwającym 4 tygodnie, obejmującym 32 chorych z oporną ciężką astmą i neutrofilią dróg oddechowych.14 Leczenie tą cząsteczką spowodowało istotne zmniejszenie liczby neutrofilów we krwi obwodowej i w plwocinie oraz częstości lekkich zaostrzeń, a także trend w kierunku poprawy kontroli astmy ocenianej za pomocą kwestionariusza. Badanie to wskazuje, że neutrofilia dróg oddechowych może odgrywać rolę w podtrzymywaniu opornej ciężkiej astmy u niektórych chorych, ale potrzebne są większe i dłużej trwające badania w celu oceny wpływu tego leczenia na inne wskaźniki kontroli astmy, w tym na ciężkie zaostrzenia.
Leczenie skierowane na limfocyty T pomocnicze typu 2
CRTh2 jest kolejnym receptorem sprzężonym z białkami G , który odgrywa rolę w astmie poprzez aktywację limfocytów T pomocniczych typu 2 (Th2), eozynofilów i bazofilów przez prostaglandynę D2.15 Potencjalne korzyści z wybiórczego zablokowania tego receptora u chorych na astmę oceniono w badaniu z podwójną ślepą próbą i z użyciem placebo w grupie kontrolnej.16 W przeciwieństwie do wcześniej wspomnianych badań pacjenci włączeni do tego badania nie przyjmowali regularnie GKSw. Leczenie antagonistą CRTh2 spowodowało istotną poprawę natężonej objętości wydechowej pierwszosekundowej (FEV1) – o 9,2%, w porównaniu z 1,8% w grupie placebo (ale tylko w analizie per protocol). Stwierdzono również istotną poprawę jakości życia i objawów nocnych. Korzyści kliniczne są jednak mniejsze niż obserwowane w związku ze stosowaniem GKSw w małych dawkach w tej populacji chorych. W kolejnym ostatnio opublikowanym badaniu trwającym 12 tygodnie nie stwierdzono korzystnego wpływu antagonisty CRTh2 u chorych na astmę, u których leczenie GKSw nie zapewniało kontroli choroby.17 Wydaje się mało prawdopodobne, aby ta metoda leczenia przyniosła korzyści chorym z oporną ciężką astmą.
Leki przeciwmuskarynowe
Kolejnym nowym podejściem terapeutycznym u chorych, których astma nie jest kontrolowana za pomocą leczenia skojarzonego GKSw i LABA, jest stosowanie wziewnych długo działających antagonistów muskarynowych (LAMA). LAMA stanowią podstawę leczenia przewlekłej obturacyjnej choroby płuc, natomiast ich przydatności w astmie jeszcze nie udowodniono. W 2 takich samych badaniach z randomizacją oceniono wpływ LAMA (tiotropium) dokładanego do dotychczasowego leczenia na czynność płuc i występowanie zaostrzeń astmy w okresie 48 tygodni.18,19 W obu badaniach stosowanie tiotropium, w porównaniu z placebo, wiązało się z istotną poprawą FEV1, mierzonej przed kolejną dawką leku, względem wartości wyjściowych i z istotnym zmniejszeniem ryzyka ciężkich zaostrzeń astmy. Prawdopodobnie tiotropium będzie więc przydatne w tej populacji chorych jako lek trzeciego rzutu dodawany do GKSw i LABA.
Redukcja mięśniówki gładkiej dróg oddechowych
Termoplastyka oskrzeli jest bronchoskopową procedurą leczniczą polegającą na podgrzaniu ściany dróg oddechowych do 65°C za pomocą energii fal o częstotliwości radiowej.20 Do tego zabiegu używa się cewnika wprowadzonego przez bronchoskop; można go wykonać tylko w większych oskrzelach. Cała terapia obejmuje 3 bronchoskopie w odstępach kilkutygodniowych. Istnieją przekonujące dowody na to, że taki zabieg zmniejsza objętość mięśniówki gładkiej oskrzeli w miejscu jego aplikacji.21
Korzyści z termoplastyki oskrzeli wykazano początkowo u chorych ze stosunkowo dobrze kontrolowaną astmą.20 Stwierdzono zmniejszenie częstości lekkich i ciężkich zaostrzeń oraz poprawę kontroli astmy. Następnie przeprowadzono badanie nad zastosowaniem termoplastyki oskrzeli u chorych z oporną ciężką astmą.22 Badanie to potwierdziło, że termoplastyka powoduje poprawę FEV1 oraz klinicznie istotną poprawę kontroli astmy. Większe badanie – pierwsze z podwójnie ślepą próbą i z wykonywaniem w grupie kontrolnej zabiegu pozorowanego – również wykazało zmniejszenie częstości ciężkich zaostrzeń astmy oraz istotną poprawę w zakresie absencji w szkole lub w pracy z powodu astmy.23 Termoplastyka oskrzeli wiąże się jednak ze skutkami niepożądanymi. U niektórych pacjentów powstała niedodma i niekiedy wymagali oni hospitalizacji po zabiegu.20,22
Podsumowanie
Badania przedstawione powyżej stwarzają nadzieję na skuteczne leczenie opornej ciężkiej astmy. Z badań z zastosowaniem przeciwciał monoklonalnych przeciwko IL‑5 i antagonisty CXCR2 wynika, że określenie fenotypu pacjenta na podstawie rodzaju zapalenia w drogach oddechowych będzie przydatne w podejmowaniu decyzji o zastosowaniu tych leków. Jest mało prawdopodobne, aby stosowanie antagonistów CRTh2 przynosiło duże korzyści w leczeniu opornej ciężkiej astmy. Tiotropium prawdopodobnie będzie stosowane jako lek dodawany do GKSw i LABA, gdyż większość chorych z oporną ciężką astmą ma obturację dróg oddechowych. Termoplastyka oskrzeli będzie korzystna w podgrupie chorych z utrzymującymi się objawami bez zapalenia w drogach oddechowych.
PIŚMIENNICTWO
- Bateman E.D, Reddel H.K., Eriksson G. i wsp.: Overall asthma control: the relationship between current control and future risk. J. Allergy Clin. Immunol., 2010; 125: 600–608
- Cockcroft D.W., Swystun V.A.: Asthma control versus asthma severity. J. Allergy Clin. Immunol., 1996; 98: 1016–1018
- Demoly P., Annunziata K., Gubba E., Adamek L.: Repeated cross‑sectional survey of patient‑reported asthma control in Europe in the past 5 years. Eur. Respir. Rev., 2012; 21: 66–74
- Krishnan J.A., Riekert K.A., McCoy J.V. i wsp.: Corticosteroid use after hospital discharge among high‑risk adults with asthma. Am. J. Respir. Crit. Care Med., 2004; 170: 1281–1285
- Bateman E.D., Boushey H.A., Bousquet J. i wsp.: Can guideline‑defined asthma control be achieved? The Gaining Optimal Asthma ControL study. Am. J. Respir. Crit. Care Med., 2004; 170: 836–844
- Bateman E.D., Hurd S.S., Barnes P.J. i wsp.: Global strategy for asthma management and prevention: GINA executive summary. Eur. Respir. J., 2008; 31: 143–178
- Bakhireva L.N., Schatz M., Jones K.L., Chambers C.D.; Organization of Teratology Information Specialists Collaborative Research Group: Asthma control during pregnancy and the risk of preterm delivery or impaired fetal growth. Ann. Allergy Asthma Immunol., 2008; 101: 137–143
- Wenzel S.E., Schwartz L.B., Langmack E.L. i wsp.: Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics. Am. J. Respir. Crit. Care Med., 1999; 160: 1001–1008
- Nair P., Pizzichini M.M., Kjarsgaard M. i wsp.: Mepolizumab for prednisone‑dependent asthma with sputum eosinophilia. N. Engl. J. Med., 2009; 360: 985–993
- Haldar P., Brightling C.E., Hargadon B. i wsp.: Mepolizumab and exacerbations of refractory eosinophilic asthma. N. Engl. J. Med., 2009; 360: 973–984
- Castro M., Mathur S., Hargreave F. i wsp.: Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo‑controlled study. Am. J. Respir. Crit. Care Med., 2011; 184: 1125–1132
- Pavord I.D., Korn S., Howarth P. i wsp.: Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double‑blind, placebo‑controlled trial. Lancet, 2012; 380: 651–659
- McGrath K.W., Icitovic N., Boushey H.A. i wsp.: Asthma Clinical Research Network of the National Heart, Lung, and Blood Institute. A large subgroup of mild‑to‑moderate asthma is persistently noneosinophilic. Am. J. Respir. Crit. Care Med., 2012; 185: 612–619
- Nair P., Gaga M., Zervas E. i wsp.: Safety and efficacy of a CXCR2 antagonist in patients with severe asthma and sputum neutrophils: a randomized, placebo‑controlled clinical trial. Clin. Exp. Allergy, 2012; 42: 1097–1103
- Hirai H., Tanaka K., Yoshie O. i wsp.: Prostaglandin D2 selectively induces chemotaxis in T helper type 2 cells, eosinophils, and basophils via seven‑transmembrane receptor CRTH2. J. Exp. Med., 2001; 193: 255–261
- Barnes N., Pavord I., Chuchalin A. i wsp.: A randomized, double‑blind, placebo‑controlled study of the CRTH2 antagonist OC000‑459 in moderate persistent asthma. Clin. Exp. Allergy, 2012; 42: 38–48
- Busse W.W., Wenzel S.E., Meltzer E.O. i wsp.: Safety and efficacy of the prostaglandin D(2) receptor antagonist AMG 853 in asthmatic patients. J. Allergy Clin. Immunol., 2012 Nov 19 [Epub ahead of print]
- Kerstjens H.A., Engel M., Dahl R. i wsp.: Tiotropium in asthma poorly controlled with standard combination therapy. N. Engl. J. Med., 2012; 367: 1198–1207
- Wenzel S.E.: Tiotropium for severe asthma: a step forward or more of the same? Pol. Arch. Med. Wewn., 2012; 122: 525–526
- Cox G., Thomson N.C., Rubin A.S. i wsp.: Asthma control during the year after bronchial thermoplasty. N. Engl. J. Med., 2007; 356: 1327–1337
- Miller J.D., Cox G., Vincic L. i wsp.: A prospective feasibility study of bronchial thermoplasty in the human airway. Chest, 2005; 127: 1999–2006
- Pavord I.D., Cox G., Thomson N.C. i wsp.: Safety and efficacy of bronchial thermoplasty in symptomatic, severe asthma. Am. J. Respir. Crit. Care Med., 2007; 176: 1185–1191
- Castro M., Rubin A.S., Laviolette M. i wsp.: Effectiveness and safety of bronchial thermoplasty in the treatment of severe asthma: a multicenter, randomized, double‑blind, sham‑controlled clinical trial. Am. J. Respir. Crit. Care Med., 2010; 181: 116–124



