dr med. Marek Bodzioch
Zakład Neurogenetyki, Uniwersytet Jagielloński Collegium Medicum, Kraków
Wprowadzenie
 Chociaż każdy stosowany współcześnie lek jest bardzo dobrze scharakteryzowany pod względem właściwości farmakodynamicznych i farmakokinetycznych oraz profilu działań niepożądanych, indywidualna odpowiedź kliniczna pacjenta na leczenie jest często trudna do przewidzenia. Efekty leczenia zależą w dużej mierze od prawidłowego rozpoznania choroby i zastosowania odpowiedniej dla tego rozpoznania terapii. Na wybór sposobu leczenia ważny wpływ mają również indywidualne cechy pacjenta, takie jak wiek, choroby współistniejące lub inne stosowane leki. Coraz większe znaczenie przypisuje się również cechom wrodzonym, uwarunkowanym genetycznie, które mogą decydować na przykład o szybszym lub wolniejszym tempie przemian metabolicznych leku (wymagającym większego lub mniejszego dawkowania) lub skłonności do reakcji alergicznych. Zagadnienia indywidualnej odpowiedzi na leki w zależności od wrodzonych cech genetycznych pacjenta są przedmiotem zainteresowania farmakogenetyki . Dziedzina ta stanowi jedną z podstaw tzw. medycyny spersonalizowanej , której celem jest indywidualny dobór optymalnej dla danego chorego terapii z uwzględnieniem jego unikalnych predyspozycji genetycznych.
Chociaż każdy stosowany współcześnie lek jest bardzo dobrze scharakteryzowany pod względem właściwości farmakodynamicznych i farmakokinetycznych oraz profilu działań niepożądanych, indywidualna odpowiedź kliniczna pacjenta na leczenie jest często trudna do przewidzenia. Efekty leczenia zależą w dużej mierze od prawidłowego rozpoznania choroby i zastosowania odpowiedniej dla tego rozpoznania terapii. Na wybór sposobu leczenia ważny wpływ mają również indywidualne cechy pacjenta, takie jak wiek, choroby współistniejące lub inne stosowane leki. Coraz większe znaczenie przypisuje się również cechom wrodzonym, uwarunkowanym genetycznie, które mogą decydować na przykład o szybszym lub wolniejszym tempie przemian metabolicznych leku (wymagającym większego lub mniejszego dawkowania) lub skłonności do reakcji alergicznych. Zagadnienia indywidualnej odpowiedzi na leki w zależności od wrodzonych cech genetycznych pacjenta są przedmiotem zainteresowania farmakogenetyki . Dziedzina ta stanowi jedną z podstaw tzw. medycyny spersonalizowanej , której celem jest indywidualny dobór optymalnej dla danego chorego terapii z uwzględnieniem jego unikalnych predyspozycji genetycznych.
Zmienność genetyczna i leki
Procesy farmakodynamiczne (dotyczące mechanizmów działania terapeutycznego) i farmakokinetyczne (odnoszące się do przemian metabolicznych leku w ustroju), a także reakcje alergiczne zależą od interakcji leku z różnymi białkami organizmu. Leki wywierają swoje działanie lecznicze na przykład poprzez hamowanie lub pobudzanie określonych receptorów, są rozkładane i usuwane z ustroju za pośrednictwem różnych enzymów i białek transportowych, a wskutek oddziaływania z białkami układu odpornościowego wywołują niekiedy reakcje alergiczne.
Białka, z którymi leki wchodzą w interakcje, są kodowane przez swoiste geny. Większość genów zawiera warianty polimorficzne, które odpowiadają za niewielkie różnice funkcji kodowanych przez nie białek u poszczególnych osób. Występowanie polimorfizmów genetycznych jest naturalnym zjawiskiem, decydującym o unikalnych, indywidualnych cechach każdego człowieka, takich jak wzrost, kolor oczu, uzdolnienia itd. Indywidualna zmienność funkcji białek wchodzących w interakcje z lekami stanowi jeszcze jedną kategorię różnic międzyosobniczych, które ujawniają się dopiero w chwili zastosowania określonego leku.
Skuteczność tego samego leku u dwóch pacjentów chorych na tę samą chorobę może być odmienna ze względu na wrodzone, uwarunkowane genetycznie różnice, sprawiające na przykład, że u jednej osoby lek silniej wiąże się z receptorem i bardziej go pobudza lub hamuje, a u innej wiązanie tego leku z receptorem jest słabsze i efekty leczenia są gorsze. Różnice mogą dotyczyć także większej lub mniejszej aktywności enzymów rozkładających lek, co przekłada się na szybsze lub wolniejsze usuwanie leku z ustroju i w konsekwencji konieczność stosowania większego lub mniejszego dawkowania. Ponadto niektórzy pacjenci wykazujący określone warianty genów układu odpornościowego mogą się cechować większą lub mniejszą skłonnością do występowania reakcji alergicznych w czasie leczenia.
Farmakogenetyczne aspekty leczenia padaczki
Podstawą skutecznego leczenia przeciwpadaczkowego jest wybór leku, który jest odpowiedni dla danego typu padaczki lub zespołu padaczkowego. Neurolodzy opiekujący się chorymi na padaczkę doskonale jednak wiedzą, że efekty leczenia przeciwpadaczkowego są często bardzo różne i nieprzewidywalne nawet u pacjentów wykazujących ten sam zespół kliniczny. Problemy mogą dotyczyć nieskuteczności leku (a niekiedy wręcz paradoksalnego nasilenia napadów), trudności w podtrzymaniu stężenia terapeutycznego lub występowania nietolerowanych i czasem zagrażających życiu działań niepożądanych. Nieoczekiwane niepowodzenie leczenia przedłuża i utrudnia proces terapeutyczny, niekorzystnie wpływa na nastawienie pacjenta do leczenia i stanowi dodatkowe obciążenie dla systemu opieki medycznej.
Jednym ze sposobów optymalizacji leczenia przeciwpadaczkowego może być uwzględnienie indywidualnych czynników farmakogenetycznych. Mimo znaczącego postępu, jaki dokonał się w ostatnich latach w tej dziedzinie, dostępne dane naukowe nie są jeszcze w większości dostatecznie wiarygodne, aby sformułować na ich podstawie jednoznaczne zalecenia dotyczące wykorzystania testów genetycznych w procesie wyboru leku przeciwpadaczkowego. Należy jednak odnotować wydane niedawno przez Food and Drug Administration i znajdujące się na ulotce leku zalecenie wykonywania badań na nosicielstwo allelu HLA-B*15:02 przed rozpoczęciem leczenia karbamazepiną u pacjentów pochodzenia azjatyckiego1. Ten wariant genetyczny, występujący szczególnie często w populacjach azjatyckich, wiąże się z bardzo dużym ryzykiem wystąpienia w czasie leczenia karbamazepiną poważnych skórnych reakcji alergicznych, takich jak zespół Stevensa i Johnsona i toksyczna martwica rozpływna naskórka. Można oczekiwać, że w przyszłości zalecenia farmakogenetyczne będą formułowane coraz częściej, istotnie zmieniając podejście do leczenia przeciwpadaczkowego.
Podsumowanie
Czynniki farmakogenetyczne mogą mieć istotne znaczenie w przewidywaniu indywidualnej odpowiedzi na leczenie przeciwpadaczkowe u poszczególnych chorych. Wykrywanie stanu nosicielstwa allelu HLA-B*15:02 przed rozpoczęciem leczenia karbamazepiną zapobiega wystąpieniu ciężkich i zagrażających życiu powikłań alergicznych u pacjentów pochodzących z Azji Wschodniej i Południowej.
Niektóre warianty polimorficzne genów pośredniczących w działaniu terapeutycznym karbamazepiny lub odpowiedzialnych za jej przemiany metaboliczne mogą w różny sposób wpływać na farmakodynamikę i farmakokinetykę leku. Nosiciele wariantów genetycznych, powodujących względną oporność zależnych od napięcia kanałów sodowych na karbamazepinę lub przyspieszających jej rozkład i/lub usuwanie z komórek, mogą wymagać częstszego dawkowania ilub stosowania większych dawek leku. Tymczasem nosiciele polimorfizmów związanych ze względną podatnością kanałów sodowych na karbamazepinę, przedłużonym metabolizmem leku i/lub jego wolniejszym usuwaniem z komórek mogą wymagać rzadszego dawkowania i/lub stosowania mniejszych dawek.
Większość danych naukowych dotyczących farmakogenetyki karbamazepiny (i innych leków) pochodzi jednak z pojedynczych badań, obejmujących niewielu uczestników, prowadzonych w różnych populacjach etnicznych i mających liczne ograniczenia metodologiczne. Dostępne obecnie dane są zatem niewystarczające do sformułowania dalszych praktycznych zaleceń farmakogenetycznych (poza testami na nosicielstwo HLA-B*15:02 u Azjatów). Można się jednak spodziewać, że czynniki farmakogenetyczne będę odgrywać coraz większą rolę w leczeniu przeciwpadaczkowym w miarę uzyskiwania bardziej wiarygodnych danych z prawidłowo zaplanowanych badań obejmujących duże grupy pacjentów.
Rycina.
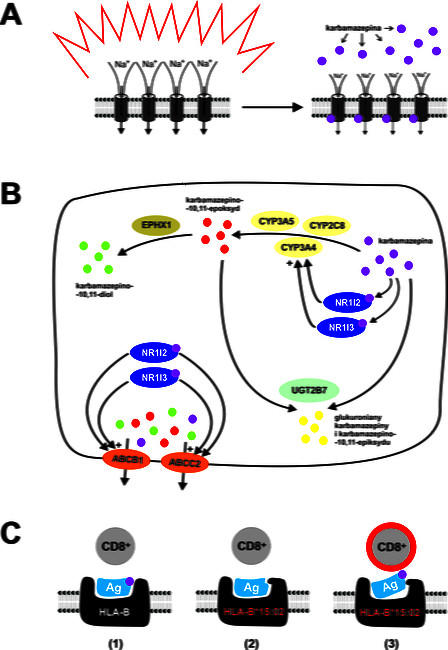 Schemat ilustrujący w uproszczeniu sposób działania farmakologicznego i szlaki przemian metabolicznych karbamazepiny oraz mechanizm reakcji alergicznych związanych z wariantem HLA*B15:02. (A) Karbamazepina wpływa hamująco na kanały sodowe, zmniejszając nadmierną pobudliwość neuronów kory mózgowej u chorych na padaczkę. Karbamazepina wiąże się prawdopodobnie z wewnątrzkomórkowym fragmentem podjednostki alfa, tworzącej właściwy kanał dla przepływu jonów Na+. (B) W wątrobie karbamazepina jest metabolizowana za pomocą cytochromu CYP3A4 przy współudziale cytochromów CYP2C8 i CYP3A5 do karbamazepino-10,11-epoksydu, który następnie podlega przemianie w karbamazepino-10,11-diol pod wpływem mikrosomalnej hydrolazy epoksydu typu 1 (EPH1). Karbamazepina i jej metabolity są usuwane z komórki za pośrednictwem transporterów kasetowych ABC – ABCB1 i ABCC2. Łącząc się z receptorami jądrowymi NR1I2 i NR1I3, karbamazepina indukuje własne przemiany metaboliczne. Pobudzone receptory NR1I2 i NR1I3 zwiększają ekspresję zarówno cytochromu CYP3A4, jak i transporterów ABCB1 i ABCB2. Karbamazepina i karbamazepino-10,11-epoksyd mogą również podlegać glukuronidacji w reakcji katalizowanej przez glikozylotransferazę urydyno-5’-difosforanu (UDGT2B7). (C) Modyfikacja własnych antygenów (Ag) przez karbamazepinę zwykle nie wpływa na utratę tolerancji immunologicznej (1). Prezentacja niezmienionego autoantygenu przez cząsteczkę HLA-B*15:02 jest prawidłowa i nie wyzwala reakcji immunologicznej (2). Ten wariant HLA-B nie prezentuje jednak prawidłowo antygenu modyfikowanego przez karbamazepinę. W efekcie cytotoksyczne limfocyty CD8+ rozpoznają taki autoantygen jako obcy i ulegają pobudzeniu, uruchamiając reakcję immunologiczną (3).
Schemat ilustrujący w uproszczeniu sposób działania farmakologicznego i szlaki przemian metabolicznych karbamazepiny oraz mechanizm reakcji alergicznych związanych z wariantem HLA*B15:02. (A) Karbamazepina wpływa hamująco na kanały sodowe, zmniejszając nadmierną pobudliwość neuronów kory mózgowej u chorych na padaczkę. Karbamazepina wiąże się prawdopodobnie z wewnątrzkomórkowym fragmentem podjednostki alfa, tworzącej właściwy kanał dla przepływu jonów Na+. (B) W wątrobie karbamazepina jest metabolizowana za pomocą cytochromu CYP3A4 przy współudziale cytochromów CYP2C8 i CYP3A5 do karbamazepino-10,11-epoksydu, który następnie podlega przemianie w karbamazepino-10,11-diol pod wpływem mikrosomalnej hydrolazy epoksydu typu 1 (EPH1). Karbamazepina i jej metabolity są usuwane z komórki za pośrednictwem transporterów kasetowych ABC – ABCB1 i ABCC2. Łącząc się z receptorami jądrowymi NR1I2 i NR1I3, karbamazepina indukuje własne przemiany metaboliczne. Pobudzone receptory NR1I2 i NR1I3 zwiększają ekspresję zarówno cytochromu CYP3A4, jak i transporterów ABCB1 i ABCB2. Karbamazepina i karbamazepino-10,11-epoksyd mogą również podlegać glukuronidacji w reakcji katalizowanej przez glikozylotransferazę urydyno-5’-difosforanu (UDGT2B7). (C) Modyfikacja własnych antygenów (Ag) przez karbamazepinę zwykle nie wpływa na utratę tolerancji immunologicznej (1). Prezentacja niezmienionego autoantygenu przez cząsteczkę HLA-B*15:02 jest prawidłowa i nie wyzwala reakcji immunologicznej (2). Ten wariant HLA-B nie prezentuje jednak prawidłowo antygenu modyfikowanego przez karbamazepinę. W efekcie cytotoksyczne limfocyty CD8+ rozpoznają taki autoantygen jako obcy i ulegają pobudzeniu, uruchamiając reakcję immunologiczną (3).
Piśmiennictwo
- Information for healthcare professionals: dangerous or even fatal skin reactions – carbamazepine (marketed as Carbatrol, Equetro, Tegretol, and generics). Dostępne (4.02.2013) pod adresem: http://www.fda.gov/Drugs/DrugSafety/PostmarketdrugsafetyinformationforPatientsandProviders/ucm124718.htm.
- Kuo C.C., Chen R.S., Lu L., Chen R.C.: Carbamazepine inhibition of neuronal Na+ currents: quantitative distinction from phenytoin and possible therapeutic implications. Mol. Pharmacol. 1997; 51: 1077–1083.
- Tate S.K., Depondt C., Sisodiya S.M. i wsp.: Genetic predictors of the maximum doses patients receive during clinical use of the anti-epileptic drugs carbamazepine and phenytoin. Proc. Natl. Acad. Sci. U S A. 2005; 102: 5507–5512.
- Hung C.C., Chang W.L., Ho J.L. i wsp.: Association of polymorphisms in EPHX1, UGT2B7, ABCB1, ABCC2, SCN1A and SCN2A genes with carbamazepine therapy optimization. Pharmacogenomics. 2012; 13: 159–169.
- Thompson C.H., Kahlig K.M., George A.L. Jr.: SCN1A splice variants exhibit divergent sensitivity to commonly used antiepileptic drugs. Epilepsia 2011; 52: 1000–1009.
- Kwan P., Poon W.S., Ng H.K. i wsp.: Multidrug resistance in epilepsy and polymorphisms in the voltage-gated sodium channel genes SCN1A, SCN2A, and SCN3A: correlation among phenotype, genotype, and mRNA expression. Pharmacogenet. Genomics. 2008; 18: 989–998.
- Konsil J., Dechasathian S., Mason D.H. Jr, Stevens R.E.: Reanalysis of carbamazepine and carbamazepine-epoxide pharmacokinetics after multiple dosing of extended release formulation. J. Pharm. Sci. 2002; 5: 169–175.
- Oscarson M., Zanger U.M., Rifki O.F. i wsp.: Transcriptional profiling of genes induced in the livers of patients treated with carbamazepine. Clin. Pharmacol. Ther. 2006; 80: 440–456.
- Puranik Y.G., Birnbaum A.K., Marino S.E. i wsp.: Association of carbamazepine major metabolism and transport pathway gene polymorphisms and pharmacokinetics in patients with epilepsy. Pharmacogenomics 2013; 14: 35–45.
- Chung W.H., Hung S.I., Hong H.S. i wsp.: Medical genetics: a marker for Stevens-Johnson syndrome. Nature 2004; 428: 486.
- Chen P., Lin J.J., Lu C.S. i wsp.; Taiwan SJS Consortium: Carbamazepine-induced toxic effects and HLA-B*1502 screening in Taiwan. N. Engl. J. Med. 2011; 364: 1126–1133.
- Roujeau J.C., Stern R.S.: Severe adverse cutaneous reactions to drugs. N. Engl. J. Med. 1994; 331: 1272–1285.
- Illing P.T., Vivian J.P., Purcell A.W., Rossjohn J., McCluskey J.: Human leukocyte antigen-associated drug hypersensitivity. Curr. Opin. Immunol. 2012; http://dx.doi.org/10.1016/j.coi.2012.10.002.
- McCormack M., Alfirevic A., Bourgeois S. i wsp.: HLA-A*3101 and carbamazepine-induced hypersensitivity reactions in Europeans. N. Engl. J. Med. 2011; 364: 1134–1143.
Artykuł stanowi część publikacji której pełny tekst ukaże się w Medycynie Praktycznej-Neurologii



